Tin chuyên ngành
on Wednesday 25-10-2023 10:26pm
Danh mục: Vô sinh & hỗ trợ sinh sản
CN. Nguyễn Như Quỳnh, ThS. Nguyễn Hữu Duy
IVFMD Vạn Hạnh
1. Tổng quan
Hiện nay, những tiến bộ trong thụ tinh trong ống nghiệm (In vitro fertilization – IVF) mang đến hy vọng cho nhiều trường hợp vô sinh hiếm muộn. Tuy nhiên, mặc dù đã có nhiều cải thiện về điều kiện và công nghệ nuôi cấy, chỉ khoảng 30% số noãn thụ tinh có thể phát triển đến giai đoạn phôi nang. Phôi có thể ngừng phát triển ở bất kì giai đoạn nào, từ giai đoạn hợp tử đến giai đoạn phôi nang[12]. Thống kê ở các trung tâm IVF hàng đầu cho thấy khoảng 50% hợp tử sẽ ngừng phát triển trước khi đến giai đoạn phôi nang và hơn 40% bệnh nhân có ít nhất một phôi ngừng phát triển khi thực hiện IVF[7].
Sự phát triển bình thường của phôi tiền làm tổ có thể được chia thành 3 giai đoạn chính: i) giai đoạn phân chia, các phôi bào phân chia đơn giản và liên tục, ii) giai đoạn phôi dâu, các phôi bào kết khối và tăng mối liên kết thông tin, iii) giai đoạn phôi nang, phôi hình thành khoang chứa dịch ở giữa phôi và các tế bào bắt đầu biệt hoá. Lần phân bào đầu tiên diễn ra khoảng 24 giờ sau thụ tinh. Lần phân bào thứ 2 diễn ra khoảng 40 giờ sau thụ tinh. Vào ngày thứ 3, phôi có ít nhất 6 tế bào[4]. Khi các cầu nối bắt đầu phát triển giữa các phôi bào, quá trình nén bắt đầu diễn ra để hình thành phôi dâu. Lúc này, phôi dâu là một khối tế bào hình cầu. Sau đó, phôi dâu hình thành khoang chứa dịch và phôi bước vào giai đoạn phôi nang. Ngoài cùng phôi nang là một lớp tế bào lớn, dẹt gọi là lớp tế bào lá nuôi (trophectoderm cell – TE) và tại một điểm ở mặt trong của lớp tế bào này có một khối tế bào riêng biệt, gọi là khối tế bào bên trong (inner cell mass – ICM). Vào thời điểm 5 ngày sau thụ tinh, số tế bào trong phôi vào khoảng 70 – 100 tế bào[2]. Song song với những thay đổi về mặt hình thái và số lượng tế bào là những thay đổi về hoạt hoá các gen trong nhân. Tại thời điểm phôi 8 tế bào, bộ gen hợp tử được kích hoạt càng lúc càng mạnh, biểu hiện bằng sự thoái hoá các yếu tố phiên mã có nguồn gốc từ mẹ, phôi bắt đầu phát triển theo sự điều hoà của chính bộ gen phôi (Hình 1) [3].
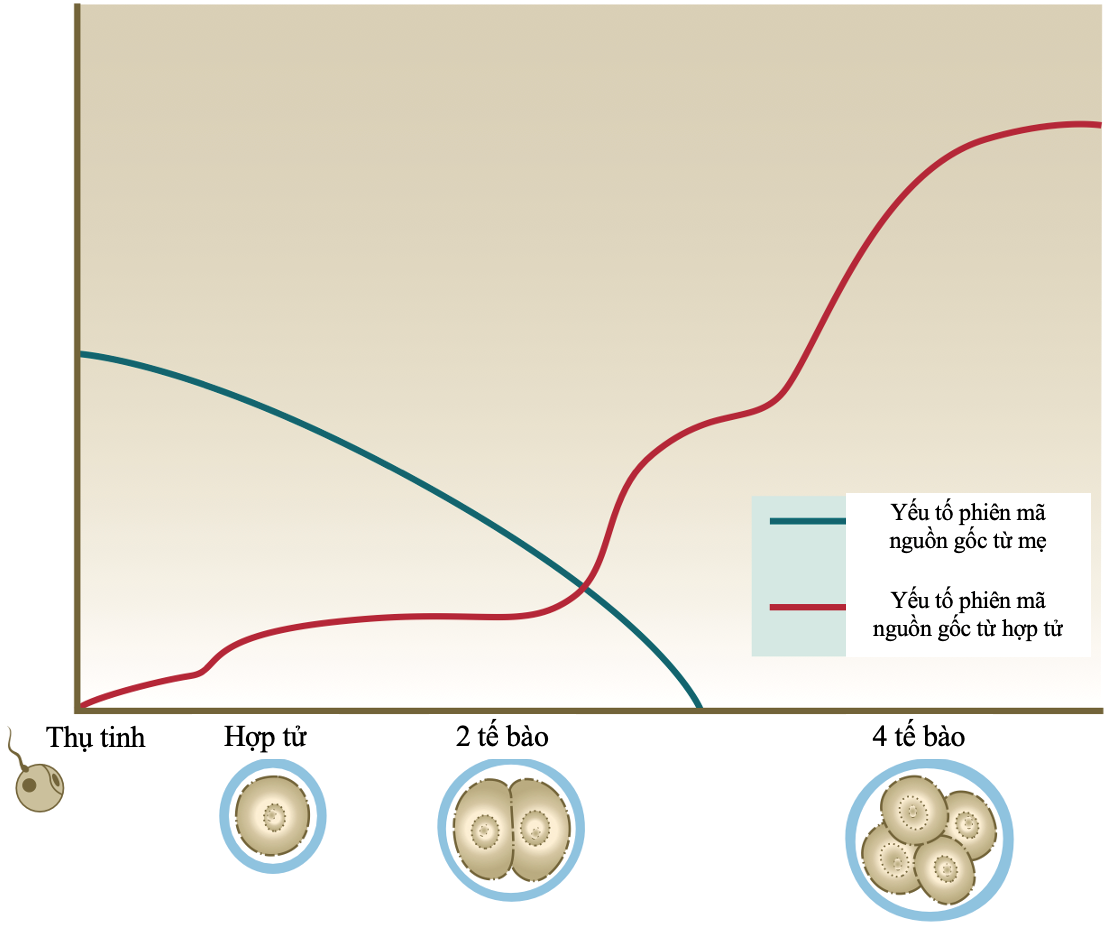
Hình 1. Sự thay đổi của các yếu tố phiên mã có nguồn gốc từ mẹ và hợp tử phôi phân chia giai đoạn sớm[1]
Phôi thường ngừng phát triển vào ngày 3 hoặc ngày 4 sau thụ tinh. Với kiểu hình đặc trưng ở phôi ngày 3 là có diễn ra hoạt động phân chia nhưng không đạt đến giai đoạn 8 tế bào. Phôi ngày 4 đã đạt đến giai đoạn 8 tế bào nhưng không thể phát triển đến giai đoạn phôi dâu. Phôi ngừng phát triển có sự giảm điều hoà các quá trình biến dưỡng và không xảy ra các hoạt động phân chia phôi bào. Một phôi được xác định là ngừng phát triển khi phôi không diễn ra hoạt động phân cắt và không có dấu hiệu phân chia tế bào trong ít nhất 24 giờ. Ngoài ra, phôi bào ở những phôi ngừng phát triển có thể bị thoái hoá hoặc ly giải hoàn toàn. Bên cạnh đó, đối với phôi phát triển chậm, phôi có thể ngừng phát triển hoàn toàn hoặc chúng có thể tiếp tục quá trình phát triển và nếu may mắn, có thể phát triển đến giai đoạn phôi nang dẫn đến trẻ sinh sống với kết quả trẻ sơ sinh tốt mặc dù tiên lượng của phôi phát triển chậm là không cao[9].
2. Nguyên nhân dẫn đến hiện tượng phôi ngừng phát triển khi nuôi cấy trong IVF
Phôi ngừng phát triển có thể được chia thành 3 dạng dựa trên giai đoạn phát triển của phôi:
- Dạng 1: phôi vẫn ở giai đoạn hợp tử, 2 phôi bào và 4 phôi bào
- Dạng 2: phôi ở giai đoạn có từ 4 phôi bào đến 8 phôi bào
- Dạng 3: phôi ở giai đoạn giữa phôi phân chia ngày 3 và phôi dâu
Dạng 1 thất bại trong việc chuyển đổi quá trình điều hoà một cách chính xác từ bộ gen của mẹ sang bộ gen hợp tử. Ở dạng 2 và 3, phôi có mức độ đường phân thấp, tuy nhiên dạng 2 có mức độ phosphoryl hoá cao trong khi dạng 3 lại thấp. Ba dạng này đều dẫn đến kết quả là quá trình phát triển của phôi bị ngừng lại[12].
Phôi ngừng phát triển bước vào trạng thái “lão hoá” đặc trưng bởi sự điều hoà tăng hoạt động của p53 (gen mã hoá cho protein có chức năng điều hoà chu kì tế bào), MYC (họ gen mã hoá các protein tham gia nhiều chức năng của tế bào như phát triển và trưởng thành tế bào, quá trình chết đi của tế bào), FOXO1 (điều khiển chu kì tế bào, quá trình biến dưỡng của tế bào, quá trình chết đi của tế bào) cùng với việc giảm điều hoà diện rộng của ribisome, histon và các yếu tố khởi động dịch mã[12].
Một số cơ chế dẫn đến hiện tượng ngừng phát triển phôi trong IVF đã được nêu ra gần đây. Giả thiết nổi bật nhất là hiện tượng phôi ngừng phát triển được xem như một cơ chế bảo vệ nhằm ngăn chặn sự phát triển hơn nữa của những phôi kém chất lượng hoặc bất thường. Những bất thường của nhiễm sắc thể như dị bội, lệch bội và khảm là nguyên nhân chính làm phôi ngừng phát triển. Nhiều nghiên cứu đã chứng minh được có mối liên hệ giữa phân chia bất thường và quá trình chết tế bào do bị mất nhiễm sắc chất. Tuy nhiên, khi phân tích nhiễm sắc chất bị mất do sai sót trong quá trình nguyên phân lại không xác định được xu hướng bất thường bắt nguồn từ bố hay mẹ[9].
2.1. Ảnh hưởng của các gen đột biến có nguồn gốc từ mẹ
Sự trưởng thành của noãn gây ra những thay đổi đáng kể trong nhân và tế bào chất, dẫn đến sự ức chế hoạt động phiên mã. Kết quả là quá trình thụ tinh và phát triển sớm của phôi phụ thuộc vào mRNA và protein có nguồn gốc từ gen của mẹ (maternal effect gens – MEGs). Những thành phần này được dự trữ trong tế bào chất ở noãn chưa trưởng thành và kiểm soát sự biểu hiện gen cho đến khi bộ gen hợp tử (zygotic gen activation – ZGA) được kích hoạt. Ở phôi tiền làm tổ, ZGA kích hoạt ở giai đoạn 4 – 8 tế bào. Do đó, không có gì đáng ngạc nhiên khi một số nghiên cứu cho thấy đột biến MEGs có liên quan đến việc ngừng phát triển trong quá trình nuôi cấy phôi[7].
TUBB8 là một đại diện nổi bật thuộc nhóm MEGs, phiên mã cho một beta-tubulin đặc hiệu, có biểu hiện ở noãn và xuyên suốt quá trình phân chia đầu tiên của phôi. Đột biến TUBB8 ảnh hưởng đến hoạt động của các vi ống, sự tập hợp thoi vô sắc ở noãn và liên quan đến hiện tượng ngừng phát triển ở phôi giai đoạn sớm[5,9].
Đột biến ở các MEGs khác cũng liên quan đến việc phôi ngừng phát triển như CDC20 (chu kì phân chia tế bào thứ 20) – giúp quá trình chuyển đổi từ giai đoạn kì giữa sang kì sau; TRIP13 (chất tương tác thụ thể hormone tuyến giáp 13) – là một thành phần của điểm kiểm tra lắp ráp trục chính; BTG4 (gen chuyển vị tế bào B-4) – điều hoà quá trình thoái hoá của các mRNA có nguồn gốc từ mẹ trước khi chuyển từ bộ gen mẹ sang bộ gen hợp tử. Đồng thời, nhiều nghiên cứu thực hiện trên mô hình động vật đã đưa ra những kết quả tương tự về ảnh hưởng của MEGs đối với sự ngừng phát triển phôi. Cũng được mã hoá bởi MEGs, phức hợp SCMC (subcortical maternal complex) là phức hợp protein biểu hiện duy nhất trong noãn và phôi sớm ở động vật có vú, cần thiết cho sự phát triển của hợp tử và quá trình phân chia tế bào phôi đầu tiên. Đột biến ở những gen mã hoá cho phức hợp SCMC (KHDC3L, NLRP2, NLRP5, PADI6, TLE6) có liên quan đến nguyên nhân gây ngừng phát triển phôi[7].
2.2. Gián đoạn quá trình phân chia tế bào, điểm kiểm tra chu kì tế bào và điều hoà ribosome
Trong suốt quá trình tế bào phân chia, sự điều hoà chu kì tế bào và hoạt động chức năng của ribosome rất cần thiết cho sự phát triển phôi. Đột biến ở bất kì gen nào có liên quan đến hoạt động chức năng này đều có thể làm phôi ngừng phát triển (Bảng 1) [7].
Bảng 1. Gen và cơ chế liên quan đến hiện tượng phôi ngừng phát triển[7]
2.3. Yếu tố ti thể
Một số quá trình mà ti thể đóng vai trò chính trong khả năng sinh sản và sự rối loạn điều hoà của các cơ chế này có thể làm khiếm khuyết quá trình phát triển bình thường của phôi. Khi một lượng các protein gấp cuộn sai tích tụ trong chất nền, ti thể sẽ kích hoạt phản ứng mtUPR (mitochondrial unfolded protein) đáp ứng lại hiện tượng này. Trong đó, CLPP (caseinolytic peptidase P – CLPP) đóng vai trò quan trọng trong quá trình này thông qua việc thúc đẩy sự phân cắt của những protein không gấp hoặc gấp sai này. Thử nghiệm cho thấy mô hình chuột bị mất CLPP phát triển ít tế bào noãn trưởng thành, phôi 2 tế bào và không hình thành phôi nang[7].
2.4. RNA mạch dài không mã hoá
Các nghiên cứu trước đây cho thấy các RNA mạch dài không mã hoá (long noncoding RNAs – lncRNAs) tham gia vào các quá trình sinh học liên quan đến sự phát triển sớm ở phôi như sản xuất và duy trì tính toàn năng của tế bào, bất hoạt nhiễm sắc thể X và in vết di truyền gen. Nhiều nghiên cứu gần đây về lncRNAs với việc ngừng phát triển noãn và cho thấy các kiểu biểu hiện của lncRNAs trong quá trình trưởng thành noãn. NEAT1 và NORAD là lncRNAs có vai trò điều hoà nhiều quá trình sinh học khác nhau trong tế bào. NORAD cũng đóng vai trò quan trọng trong bảo tồn tính toàn vẹn của nhiễm sắc chất. Ức chế NEAT1 và NORAD có thể cản trở quá trình trưởng thành noãn, gây hư hỏng bộ gen tế bào[7].
2.5. Các yếu tố khác
Tuổi mẹ cao
Tỉ lệ phôi lệch bội nhiễm sắc thể ở phụ nữ > 35 tuổi tăng từ 30% lên 90% vào cuối độ tuổi 40 trước khi mãn kinh[10]. Phôi ở nhóm phụ nữ lớn tuổi có xu hướng ngừng phát triển ở giai đoạn 4 – 7 tế bào. Xu hướng ngừng phát triển này của phôi được dự đoán có thể biểu hiện rõ ràng hơn ở các giai đoạn sau[11].
Phân mảnh DNA tinh trùng
Phân mảnh DNA tinh trùng có tương quan nghịch với khả năng hình thành phôi nang. Tỉ lệ phân mảnh càng cao, phôi càng có nguy cơ ngừng phát triển và khởi động quá trình chết tế bào theo chương trình[8].
Kĩ thuật nuôi cấy phôi in vitro
Hai yếu tố chính có thể làm ảnh hưởng quá trình phát triển của phôi tiền làm tổ in vitro là điều kiện nuôi cấy và môi trường nuôi cấy. Nhiều nghiên cứu đã báo cáo lợi ích của việc nuôi cấy phôi ở nồng độ oxy thấp (3% hoặc 5%) như cải thiện tốc độ phát triển và số lượng phôi bào, số lượng và chất lượng phôi nang hay tỉ lệ làm tổ so với nồng độ oxy cao (20%). Bên cạnh đó, sự biểu hiện của các gen in vết có tính nhạy cảm với những thành phần trong môi trường nuôi cấy. Giảm hoạt động các gen này có thể dẫn đến nhiều ảnh hưởng nghiêm trọng[6].
3. Giải pháp giúp cải thiện tình trạng phôi nuôi cấy ngừng phát triển trong IVF
Phôi ngừng phát triển có chu kì phân chia tế bào gián đoạn. Tuy nhiên, liệu rằng trạng thái ngừng phát triển này là “tĩnh” (có thể đảo ngược) hay “lão hoá” (không thể đảo ngược) vẫn còn chưa rõ ràng, không có phương pháp cụ thể nào giúp phân biệt 2 trạng thái này của phôi, trừ việc kích hoạt lại quá trình đảo ngược. Một số chất ức chế phân tử nhỏ như chất ức chế mTOR rapamicyn, chất ức chế ERK PD0325901, vitamin C và resveratrol mà trước đây đã được chứng minh là có tác động đến sự phát triển của tế bào gốc phôi hoặc tế bào gốc đa năng. Ngoài ra, 4 hợp chất này cũng liên quan đến các khía cạnh khác nhau của quá trình phát triển phôi và “lão hoá”. Rapamicyn ức chế mTOR để thúc đẩy quá trình tự thực và được chứng minh là cải thiện sự phát triển của trứng lợn. Vitamin C là chất chống oxi hoá và điều hoà biểu hiện thượng di truyền qua khả năng tác động đến quá trình methyl hoá DNA. Chất ức chế ERK hỗ trợ quá trình thiết lập khối ICM ở phôi nang. Resveratrol được tìm thấy trong nhiều loài thực vật như nho, lạc, quả mọng và có nhiều đặc tính sinh học như chống oxi hoá, kháng viêm, kháng ung thư, có thể cải thiện sự phát triển noãn trong các nghiên cứu trên lợn, bò, và sự phát triển trong ống nghiệm của noãn người[12, 13].
Hiệu quả ứng dụng của rapamicyn, PD0325901 và vitamin C đối với phôi ngừng phát triển là khá hạn chế. Ngược lại, resveratrol – chất chống oxi hoá có tác động lên SIRT (một họ sirtuin giúp điều hoà quá trình biến dưỡng) – lại có hiệu quả đáng kể đến khả năng phát triển tiếp tục của nhóm phôi này.
Kết quả nghiên cứu về hiệu quả của resveratrol trong báo cáo của Yang và cộng sự (2022) cho thấy có 23/42 phôi tiếp tục quá trình phát triển. Tuy nhiên, cần lưu ý có 4/42 phôi bắt đầu phát triển trở lại, nhưng cuối cùng bị phân mảnh, cho thấy rằng ít nhất một số phôi được kích hoạt này lại không có khả năng phát triển thêm. Tương tự như vậy, trong khi nhiều phôi bắt đầu phát triển (19/42 phôi, chiếm 45%), chỉ có 9 phôi có thể nén chặt và chỉ có 3 phôi chuyển sang giai đoạn phôi nang. Resveratrol có thể tái kích hoạt những phôi đã ngừng phát triển trước đó, nhưng những phôi này lại tồn tại một số chướng ngại khác như sự điều hoà giảm liên tục của ribosome và các gen dịch mã[12].
Kết luận
Phôi ngừng phát triển trong IVF làm giảm số lượng phôi của bệnh nhân ở một chu kì tạo phôi, từ đó làm giảm số lượng phôi chuyển. Có nhiều nguyên nhân dẫn đến sự gián đoạn trong quá trình phát triển của phôi tiền làm tổ như đột biến các gen có nguồn gốc từ mẹ, thất bại trong việc chuyển đổi hoạt động từ bộ gen mẹ sang bộ gen hợp tử, bất thường trong con đường biến dưỡng cùng nhiều nguyên nhân khác. Ở thời điểm hiện tại, mặc dù chưa thực sự hiệu quả những resveratrol đã mang lại nhiều tín hiệu khả quan khi có thể kích hoạt lại quá trình phát triển của phôi.
Tài liệu tham khảo
IVFMD Vạn Hạnh
1. Tổng quan
Hiện nay, những tiến bộ trong thụ tinh trong ống nghiệm (In vitro fertilization – IVF) mang đến hy vọng cho nhiều trường hợp vô sinh hiếm muộn. Tuy nhiên, mặc dù đã có nhiều cải thiện về điều kiện và công nghệ nuôi cấy, chỉ khoảng 30% số noãn thụ tinh có thể phát triển đến giai đoạn phôi nang. Phôi có thể ngừng phát triển ở bất kì giai đoạn nào, từ giai đoạn hợp tử đến giai đoạn phôi nang[12]. Thống kê ở các trung tâm IVF hàng đầu cho thấy khoảng 50% hợp tử sẽ ngừng phát triển trước khi đến giai đoạn phôi nang và hơn 40% bệnh nhân có ít nhất một phôi ngừng phát triển khi thực hiện IVF[7].
Sự phát triển bình thường của phôi tiền làm tổ có thể được chia thành 3 giai đoạn chính: i) giai đoạn phân chia, các phôi bào phân chia đơn giản và liên tục, ii) giai đoạn phôi dâu, các phôi bào kết khối và tăng mối liên kết thông tin, iii) giai đoạn phôi nang, phôi hình thành khoang chứa dịch ở giữa phôi và các tế bào bắt đầu biệt hoá. Lần phân bào đầu tiên diễn ra khoảng 24 giờ sau thụ tinh. Lần phân bào thứ 2 diễn ra khoảng 40 giờ sau thụ tinh. Vào ngày thứ 3, phôi có ít nhất 6 tế bào[4]. Khi các cầu nối bắt đầu phát triển giữa các phôi bào, quá trình nén bắt đầu diễn ra để hình thành phôi dâu. Lúc này, phôi dâu là một khối tế bào hình cầu. Sau đó, phôi dâu hình thành khoang chứa dịch và phôi bước vào giai đoạn phôi nang. Ngoài cùng phôi nang là một lớp tế bào lớn, dẹt gọi là lớp tế bào lá nuôi (trophectoderm cell – TE) và tại một điểm ở mặt trong của lớp tế bào này có một khối tế bào riêng biệt, gọi là khối tế bào bên trong (inner cell mass – ICM). Vào thời điểm 5 ngày sau thụ tinh, số tế bào trong phôi vào khoảng 70 – 100 tế bào[2]. Song song với những thay đổi về mặt hình thái và số lượng tế bào là những thay đổi về hoạt hoá các gen trong nhân. Tại thời điểm phôi 8 tế bào, bộ gen hợp tử được kích hoạt càng lúc càng mạnh, biểu hiện bằng sự thoái hoá các yếu tố phiên mã có nguồn gốc từ mẹ, phôi bắt đầu phát triển theo sự điều hoà của chính bộ gen phôi (Hình 1) [3].

Hình 1. Sự thay đổi của các yếu tố phiên mã có nguồn gốc từ mẹ và hợp tử phôi phân chia giai đoạn sớm[1]
Phôi thường ngừng phát triển vào ngày 3 hoặc ngày 4 sau thụ tinh. Với kiểu hình đặc trưng ở phôi ngày 3 là có diễn ra hoạt động phân chia nhưng không đạt đến giai đoạn 8 tế bào. Phôi ngày 4 đã đạt đến giai đoạn 8 tế bào nhưng không thể phát triển đến giai đoạn phôi dâu. Phôi ngừng phát triển có sự giảm điều hoà các quá trình biến dưỡng và không xảy ra các hoạt động phân chia phôi bào. Một phôi được xác định là ngừng phát triển khi phôi không diễn ra hoạt động phân cắt và không có dấu hiệu phân chia tế bào trong ít nhất 24 giờ. Ngoài ra, phôi bào ở những phôi ngừng phát triển có thể bị thoái hoá hoặc ly giải hoàn toàn. Bên cạnh đó, đối với phôi phát triển chậm, phôi có thể ngừng phát triển hoàn toàn hoặc chúng có thể tiếp tục quá trình phát triển và nếu may mắn, có thể phát triển đến giai đoạn phôi nang dẫn đến trẻ sinh sống với kết quả trẻ sơ sinh tốt mặc dù tiên lượng của phôi phát triển chậm là không cao[9].
2. Nguyên nhân dẫn đến hiện tượng phôi ngừng phát triển khi nuôi cấy trong IVF
Phôi ngừng phát triển có thể được chia thành 3 dạng dựa trên giai đoạn phát triển của phôi:
- Dạng 1: phôi vẫn ở giai đoạn hợp tử, 2 phôi bào và 4 phôi bào
- Dạng 2: phôi ở giai đoạn có từ 4 phôi bào đến 8 phôi bào
- Dạng 3: phôi ở giai đoạn giữa phôi phân chia ngày 3 và phôi dâu
Dạng 1 thất bại trong việc chuyển đổi quá trình điều hoà một cách chính xác từ bộ gen của mẹ sang bộ gen hợp tử. Ở dạng 2 và 3, phôi có mức độ đường phân thấp, tuy nhiên dạng 2 có mức độ phosphoryl hoá cao trong khi dạng 3 lại thấp. Ba dạng này đều dẫn đến kết quả là quá trình phát triển của phôi bị ngừng lại[12].
Phôi ngừng phát triển bước vào trạng thái “lão hoá” đặc trưng bởi sự điều hoà tăng hoạt động của p53 (gen mã hoá cho protein có chức năng điều hoà chu kì tế bào), MYC (họ gen mã hoá các protein tham gia nhiều chức năng của tế bào như phát triển và trưởng thành tế bào, quá trình chết đi của tế bào), FOXO1 (điều khiển chu kì tế bào, quá trình biến dưỡng của tế bào, quá trình chết đi của tế bào) cùng với việc giảm điều hoà diện rộng của ribisome, histon và các yếu tố khởi động dịch mã[12].
Một số cơ chế dẫn đến hiện tượng ngừng phát triển phôi trong IVF đã được nêu ra gần đây. Giả thiết nổi bật nhất là hiện tượng phôi ngừng phát triển được xem như một cơ chế bảo vệ nhằm ngăn chặn sự phát triển hơn nữa của những phôi kém chất lượng hoặc bất thường. Những bất thường của nhiễm sắc thể như dị bội, lệch bội và khảm là nguyên nhân chính làm phôi ngừng phát triển. Nhiều nghiên cứu đã chứng minh được có mối liên hệ giữa phân chia bất thường và quá trình chết tế bào do bị mất nhiễm sắc chất. Tuy nhiên, khi phân tích nhiễm sắc chất bị mất do sai sót trong quá trình nguyên phân lại không xác định được xu hướng bất thường bắt nguồn từ bố hay mẹ[9].
2.1. Ảnh hưởng của các gen đột biến có nguồn gốc từ mẹ
Sự trưởng thành của noãn gây ra những thay đổi đáng kể trong nhân và tế bào chất, dẫn đến sự ức chế hoạt động phiên mã. Kết quả là quá trình thụ tinh và phát triển sớm của phôi phụ thuộc vào mRNA và protein có nguồn gốc từ gen của mẹ (maternal effect gens – MEGs). Những thành phần này được dự trữ trong tế bào chất ở noãn chưa trưởng thành và kiểm soát sự biểu hiện gen cho đến khi bộ gen hợp tử (zygotic gen activation – ZGA) được kích hoạt. Ở phôi tiền làm tổ, ZGA kích hoạt ở giai đoạn 4 – 8 tế bào. Do đó, không có gì đáng ngạc nhiên khi một số nghiên cứu cho thấy đột biến MEGs có liên quan đến việc ngừng phát triển trong quá trình nuôi cấy phôi[7].
TUBB8 là một đại diện nổi bật thuộc nhóm MEGs, phiên mã cho một beta-tubulin đặc hiệu, có biểu hiện ở noãn và xuyên suốt quá trình phân chia đầu tiên của phôi. Đột biến TUBB8 ảnh hưởng đến hoạt động của các vi ống, sự tập hợp thoi vô sắc ở noãn và liên quan đến hiện tượng ngừng phát triển ở phôi giai đoạn sớm[5,9].
Đột biến ở các MEGs khác cũng liên quan đến việc phôi ngừng phát triển như CDC20 (chu kì phân chia tế bào thứ 20) – giúp quá trình chuyển đổi từ giai đoạn kì giữa sang kì sau; TRIP13 (chất tương tác thụ thể hormone tuyến giáp 13) – là một thành phần của điểm kiểm tra lắp ráp trục chính; BTG4 (gen chuyển vị tế bào B-4) – điều hoà quá trình thoái hoá của các mRNA có nguồn gốc từ mẹ trước khi chuyển từ bộ gen mẹ sang bộ gen hợp tử. Đồng thời, nhiều nghiên cứu thực hiện trên mô hình động vật đã đưa ra những kết quả tương tự về ảnh hưởng của MEGs đối với sự ngừng phát triển phôi. Cũng được mã hoá bởi MEGs, phức hợp SCMC (subcortical maternal complex) là phức hợp protein biểu hiện duy nhất trong noãn và phôi sớm ở động vật có vú, cần thiết cho sự phát triển của hợp tử và quá trình phân chia tế bào phôi đầu tiên. Đột biến ở những gen mã hoá cho phức hợp SCMC (KHDC3L, NLRP2, NLRP5, PADI6, TLE6) có liên quan đến nguyên nhân gây ngừng phát triển phôi[7].
2.2. Gián đoạn quá trình phân chia tế bào, điểm kiểm tra chu kì tế bào và điều hoà ribosome
Trong suốt quá trình tế bào phân chia, sự điều hoà chu kì tế bào và hoạt động chức năng của ribosome rất cần thiết cho sự phát triển phôi. Đột biến ở bất kì gen nào có liên quan đến hoạt động chức năng này đều có thể làm phôi ngừng phát triển (Bảng 1) [7].
Bảng 1. Gen và cơ chế liên quan đến hiện tượng phôi ngừng phát triển[7]
| Gen | Chức năng của gen/con đường tín hiệu | Kiểu hình |
| TUBB8 | Hình thành thoi vô sắc trong giảm phân | Khiếm khuyết trưởng thành noãn, phôi ngừng phát triển giai đoạn sớm |
| CDC20 | Chuyển đổi từ kì giữa sang kì sau, cần thiết cho sự thoát khỏi nguyên phân và giảm phân | Khiếm khuyết trưởng thành noãn, phôi ngừng phát triển giai đoạn sớm |
| TRIP13 | Thành phần của điểm kiểm tra lắp ráp thoi vô sắc | Ngừng giảm phân ở noãn, phân chia hợp tử bất thường |
| BTG4 | Thoái hoá mRNA nguồn gốc từ mẹ, chuyển đổi từ bộ gen mẹ sang bộ gen hợp tử | Thất bại phân chia hợp tử |
| KHDC3L | Hình thành và định vị thoi vô sắc trong nguyên phân, điều hoà quá trình dịch mã, tái phân bố các bào quan, tái lập chương trình epigenetics | Ngừng phát triển giai đoạn phôi dâu, thai trứng |
| NRLP2 | Chưa rõ | Ngừng phát triển phôi giai đoạn sớm |
| NLRP5 | Chưa rõ | Ngừng phát triển phôi giai đoạn sớm |
| PADI6 | Hoạt hoá bộ gen phôi | Ngừng phát triển phôi giai đoạn sớm |
| TLE6 | Phân chia đối xứng noãn đã thụ tinh bằng cách điều hoà khung actin | Thất bại hình thành phôi nang |
| MEI1 | Hình thành đứt gãy sợi kép và tái tổ hợp tương đồng DNA | Ngừng phát triển phôi giai đoạn sớm, thất bại làm tổ nhiều lần |
| REC114 | Hình thành đứt gãy sợi kép và tái tổ hợp tương đồng DNA | Ngừng phát triển phôi giai đoạn sớm |
| FBXO43 | Duy trì sự bắt giữ tế bào trứng và sự phát triển phôi sớm | Ngừng phát triển phôi giai đoạn sớm |
| MOS | Duy trì sự bắt giữ tế bào trứng ở giai đoạn MII thông qua hoạt hoá con đường ERK | Ngừng phát triển phôi giai đoạn sớm |
2.3. Yếu tố ti thể
Một số quá trình mà ti thể đóng vai trò chính trong khả năng sinh sản và sự rối loạn điều hoà của các cơ chế này có thể làm khiếm khuyết quá trình phát triển bình thường của phôi. Khi một lượng các protein gấp cuộn sai tích tụ trong chất nền, ti thể sẽ kích hoạt phản ứng mtUPR (mitochondrial unfolded protein) đáp ứng lại hiện tượng này. Trong đó, CLPP (caseinolytic peptidase P – CLPP) đóng vai trò quan trọng trong quá trình này thông qua việc thúc đẩy sự phân cắt của những protein không gấp hoặc gấp sai này. Thử nghiệm cho thấy mô hình chuột bị mất CLPP phát triển ít tế bào noãn trưởng thành, phôi 2 tế bào và không hình thành phôi nang[7].
2.4. RNA mạch dài không mã hoá
Các nghiên cứu trước đây cho thấy các RNA mạch dài không mã hoá (long noncoding RNAs – lncRNAs) tham gia vào các quá trình sinh học liên quan đến sự phát triển sớm ở phôi như sản xuất và duy trì tính toàn năng của tế bào, bất hoạt nhiễm sắc thể X và in vết di truyền gen. Nhiều nghiên cứu gần đây về lncRNAs với việc ngừng phát triển noãn và cho thấy các kiểu biểu hiện của lncRNAs trong quá trình trưởng thành noãn. NEAT1 và NORAD là lncRNAs có vai trò điều hoà nhiều quá trình sinh học khác nhau trong tế bào. NORAD cũng đóng vai trò quan trọng trong bảo tồn tính toàn vẹn của nhiễm sắc chất. Ức chế NEAT1 và NORAD có thể cản trở quá trình trưởng thành noãn, gây hư hỏng bộ gen tế bào[7].
2.5. Các yếu tố khác
Tuổi mẹ cao
Tỉ lệ phôi lệch bội nhiễm sắc thể ở phụ nữ > 35 tuổi tăng từ 30% lên 90% vào cuối độ tuổi 40 trước khi mãn kinh[10]. Phôi ở nhóm phụ nữ lớn tuổi có xu hướng ngừng phát triển ở giai đoạn 4 – 7 tế bào. Xu hướng ngừng phát triển này của phôi được dự đoán có thể biểu hiện rõ ràng hơn ở các giai đoạn sau[11].
Phân mảnh DNA tinh trùng
Phân mảnh DNA tinh trùng có tương quan nghịch với khả năng hình thành phôi nang. Tỉ lệ phân mảnh càng cao, phôi càng có nguy cơ ngừng phát triển và khởi động quá trình chết tế bào theo chương trình[8].
Kĩ thuật nuôi cấy phôi in vitro
Hai yếu tố chính có thể làm ảnh hưởng quá trình phát triển của phôi tiền làm tổ in vitro là điều kiện nuôi cấy và môi trường nuôi cấy. Nhiều nghiên cứu đã báo cáo lợi ích của việc nuôi cấy phôi ở nồng độ oxy thấp (3% hoặc 5%) như cải thiện tốc độ phát triển và số lượng phôi bào, số lượng và chất lượng phôi nang hay tỉ lệ làm tổ so với nồng độ oxy cao (20%). Bên cạnh đó, sự biểu hiện của các gen in vết có tính nhạy cảm với những thành phần trong môi trường nuôi cấy. Giảm hoạt động các gen này có thể dẫn đến nhiều ảnh hưởng nghiêm trọng[6].
3. Giải pháp giúp cải thiện tình trạng phôi nuôi cấy ngừng phát triển trong IVF
Phôi ngừng phát triển có chu kì phân chia tế bào gián đoạn. Tuy nhiên, liệu rằng trạng thái ngừng phát triển này là “tĩnh” (có thể đảo ngược) hay “lão hoá” (không thể đảo ngược) vẫn còn chưa rõ ràng, không có phương pháp cụ thể nào giúp phân biệt 2 trạng thái này của phôi, trừ việc kích hoạt lại quá trình đảo ngược. Một số chất ức chế phân tử nhỏ như chất ức chế mTOR rapamicyn, chất ức chế ERK PD0325901, vitamin C và resveratrol mà trước đây đã được chứng minh là có tác động đến sự phát triển của tế bào gốc phôi hoặc tế bào gốc đa năng. Ngoài ra, 4 hợp chất này cũng liên quan đến các khía cạnh khác nhau của quá trình phát triển phôi và “lão hoá”. Rapamicyn ức chế mTOR để thúc đẩy quá trình tự thực và được chứng minh là cải thiện sự phát triển của trứng lợn. Vitamin C là chất chống oxi hoá và điều hoà biểu hiện thượng di truyền qua khả năng tác động đến quá trình methyl hoá DNA. Chất ức chế ERK hỗ trợ quá trình thiết lập khối ICM ở phôi nang. Resveratrol được tìm thấy trong nhiều loài thực vật như nho, lạc, quả mọng và có nhiều đặc tính sinh học như chống oxi hoá, kháng viêm, kháng ung thư, có thể cải thiện sự phát triển noãn trong các nghiên cứu trên lợn, bò, và sự phát triển trong ống nghiệm của noãn người[12, 13].
Hiệu quả ứng dụng của rapamicyn, PD0325901 và vitamin C đối với phôi ngừng phát triển là khá hạn chế. Ngược lại, resveratrol – chất chống oxi hoá có tác động lên SIRT (một họ sirtuin giúp điều hoà quá trình biến dưỡng) – lại có hiệu quả đáng kể đến khả năng phát triển tiếp tục của nhóm phôi này.
Kết quả nghiên cứu về hiệu quả của resveratrol trong báo cáo của Yang và cộng sự (2022) cho thấy có 23/42 phôi tiếp tục quá trình phát triển. Tuy nhiên, cần lưu ý có 4/42 phôi bắt đầu phát triển trở lại, nhưng cuối cùng bị phân mảnh, cho thấy rằng ít nhất một số phôi được kích hoạt này lại không có khả năng phát triển thêm. Tương tự như vậy, trong khi nhiều phôi bắt đầu phát triển (19/42 phôi, chiếm 45%), chỉ có 9 phôi có thể nén chặt và chỉ có 3 phôi chuyển sang giai đoạn phôi nang. Resveratrol có thể tái kích hoạt những phôi đã ngừng phát triển trước đó, nhưng những phôi này lại tồn tại một số chướng ngại khác như sự điều hoà giảm liên tục của ribosome và các gen dịch mã[12].
Kết luận
Phôi ngừng phát triển trong IVF làm giảm số lượng phôi của bệnh nhân ở một chu kì tạo phôi, từ đó làm giảm số lượng phôi chuyển. Có nhiều nguyên nhân dẫn đến sự gián đoạn trong quá trình phát triển của phôi tiền làm tổ như đột biến các gen có nguồn gốc từ mẹ, thất bại trong việc chuyển đổi hoạt động từ bộ gen mẹ sang bộ gen hợp tử, bất thường trong con đường biến dưỡng cùng nhiều nguyên nhân khác. Ở thời điểm hiện tại, mặc dù chưa thực sự hiệu quả những resveratrol đã mang lại nhiều tín hiệu khả quan khi có thể kích hoạt lại quá trình phát triển của phôi.
Tài liệu tham khảo
- Carlson BM. Human embryology and developmental biology. Elsevier Health Sciences; 2018 Nov 30.
- Glujovsky D, Retamar AM, Sedo CR, Ciapponi A, Cornelisse S, Blake D. Cleavage‐stage versus blastocyst‐stage embryo transfer in assisted reproductive technology. Cochrane database of systematic reviews. 2022(5).
- McCollin A, Swann RL, Summers MC, Handyside AH, Ottolini CS. Abnormal cleavage and developmental arrest of human preimplantation embryos in vitro. European journal of medical genetics. 2020 Feb 1;63(2):103651.
- Nasiri N, Eftekhari-Yazdi P. An overview of the available methods for morphological scoring of pre-implantation embryos in in vitro fertilization. Cell Journal (Yakhteh). 2015;16(4):392.
- Paonessa M, Borini A, Coticchio G. Genetic causes of preimplantation embryo developmental failure. Molecular Reproduction and Development. 2021 May;88(5):338-48.
- Ramos‐Ibeas P, Heras S, Gómez‐Redondo I, Planells B, Fernández‐González R, Pericuesta E, Laguna‐Barraza R, Pérez‐Cerezales S, Gutiérrez‐Adán A. Embryo responses to stress induced by assisted reproductive technologies. Molecular reproduction and development. 2019 Oct;86(10):1292-306.
- Sahin GN, Yildirim RM, Seli E. Embryonic arrest: causes and implications. Current Opinion in Obstetrics and Gynecology. 2023 Jun 1;35(3):184-92.
- Sedó CA, Bilinski M, Lorenzi D, Uriondo H, Noblía F, Longobucco V, Lagar EV, Nodar F. Effect of sperm DNA fragmentation on embryo development: clinical and biological aspects. JBRA assisted reproduction. 2017 Oct;21(4):343.
- Sfakianoudis K, Maziotis E, Karantzali E, Kokkini G, Grigoriadis S, Pantou A, Giannelou P, Petroutsou K, Markomichali C, Fakiridou M, Koutsilieris M. Molecular drivers of developmental arrest in the human preimplantation embryo: a systematic review and critical analysis leading to mapping future research. International journal of molecular sciences. 2021 Aug 3;22(15):8353.
- Ubaldi FM, Cimadomo D, Vaiarelli A, Fabozzi G, Venturella R, Maggiulli R, Mazzilli R, Ferrero S, Palagiano A, Rienzi L. Advanced maternal age in IVF: still a challenge? The present and the future of its treatment. Frontiers in endocrinology. 2019 Feb 20;10:94.
- Warshaviak M, Kalma Y, Carmon A, Samara N, Dviri M, Azem F, Ben-Yosef D. The effect of advanced maternal age on embryo morphokinetics. Frontiers in endocrinology. 2019 Oct 25;10:686.
- Yang Y, Shi L, Fu X, Ma G, Yang Z, Li Y, Zhou Y, Yuan L, Xia Y, Zhong X, Yin P. Metabolic and epigenetic dysfunctions underlie the arrest of in vitro fertilized human embryos in a senescent-like state. PLoS Biology. 2022 Jun 30;20(6):e3001682.
- Yoon J, Juhn KM, Jung EH, Park HJ, Yoon SH, Ko Y, Hur CY, Lim JH. Effects of resveratrol, granulocyte-macrophage colony-stimulating factor or dichloroacetic acid in the culture media on embryonic development and pregnancy rates in aged mice. Aging (Albany NY). 2020 Feb 2;12(3):2659.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Năm 2020
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
GIỚI THIỆU SÁCH MỚI

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
Cẩm nang Hội chứng buồng trứng đa nang được phát hành online ...
FACEBOOK








